Entzündung und das Darmmikrobiom: Wie Mikroben die Darmgesundheit und Krankheiten beeinflussen




Weitere Details finden Sie unter Entzündung
-
>>
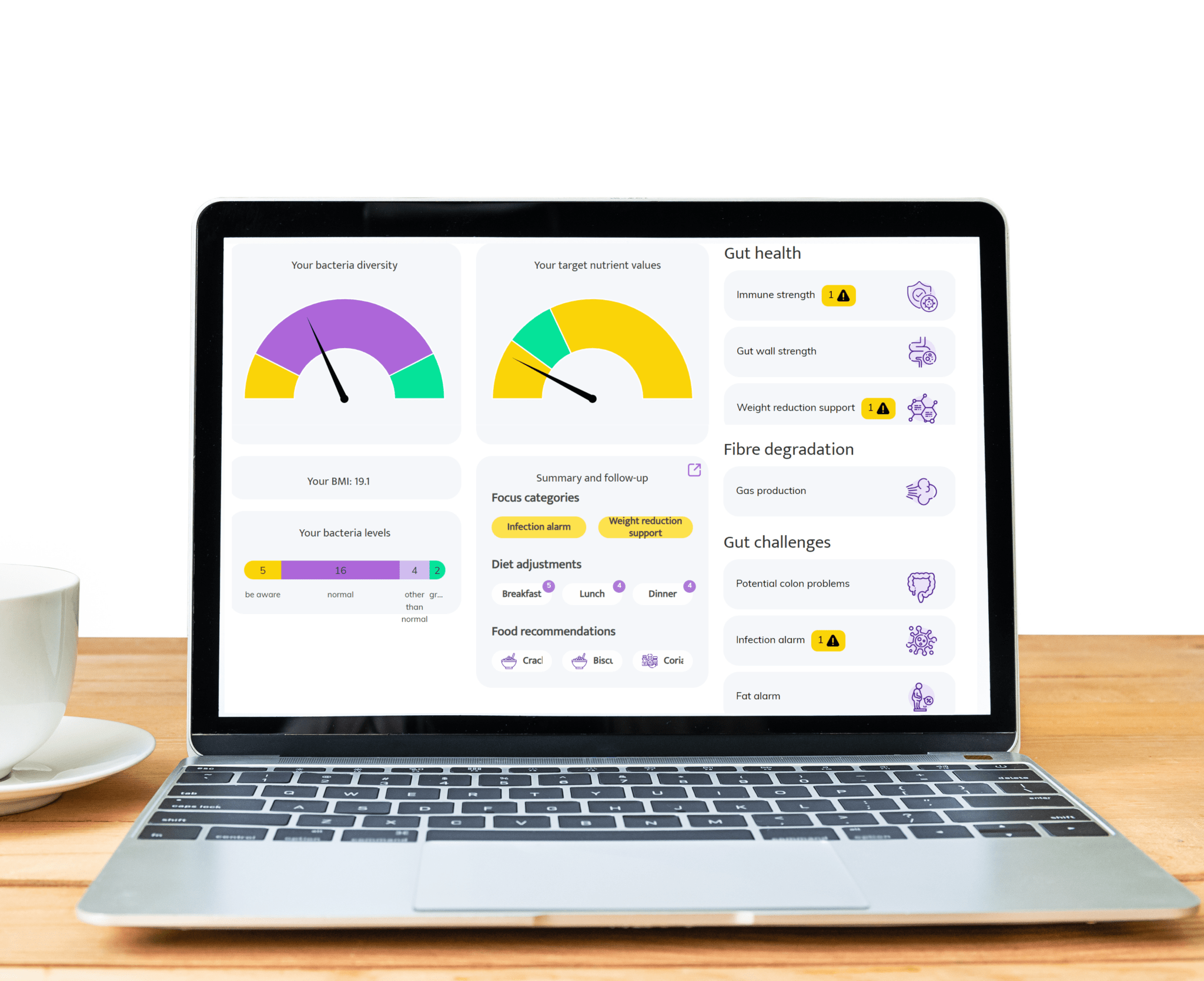
Gut-Entzündungstest: Einblicke in Ihr Darmmikrobiom gewinnen und die Darmgesundheit verbessern
>Entschlüsselung der Calprotectin-Werte: Enthüllung von Entzündungs-Insights in der Darmgesundheit und Mikrobiomanalyse
>Entzündliche Darmmarker: Einblicke in den Mikrobiom des Darms und Entzündungen für eine bessere Darmgesundheit
>Verstehen chronischer Darmentzündungen: ein Schlüssel zum Gleichgewicht des Darmmikrobioms und optimaler Darmgesundheit
>Verstehen von leichtgradiger Darmentzündung: Ihre Auswirkungen auf die Darmgesundheit und das Mikrobiom
>Das Verständnis von Entzündungen und Dysbiose: Wichtige Einblicke in Ungleichgewichte im Darmmikrobiom und ihre Auswirkungen auf Symptome im Darmgesundheit
>Einblicke in die Darm-Mikrobiom-Entschlüsselung: Immunaktivierung und Entzündung bei Symptomen und Erkrankungen der Darmgesundheit
Entzündung & SCFA: Erkenntnisse über den Darmmikrobiom für Darmgesundheit & Entzündungslinderung
Mehr lesen: Entzündung und das Darmmikrobiom – Zusammenhänge mit Darmgesundheitssymptomen und -zuständen
Bereiche, in denen InnerBuddies-Darmmikrobiomtests einen erheblichen Einfluss haben können
-
Verdauungsgesundheit
Magen-Darm-Beschwerden wie Blähungen, Verstopfung, Gas oder Durchfall entstehen oft durch ein Ungleichgewicht der Darmbakterien. InnerBuddies analysiert die Zusammensetzung und Vielfalt Ihres Mikrobioms im Darm und identifiziert spezifische Ungleichgewichte, wie zum Beispiel einen Mangel an ballaststoffverdauenden Bakterien oder ein Überwachsen von gasproduzierenden Mikroorganismen.
Durch das Aufspüren der Ursachen von Verdauungsproblemen bietet InnerBuddies personalisierte, evidenzbasierte Empfehlungen zur Unterstützung der Verdauung. Ob durch gezielte Ernährungsanpassungen, Präbiotika oder Probiotika – Nutzer können konkrete Schritte unternehmen, um Harmonie wiederherzustellen und den Komfort des Verdauungssystems zu verbessern.
-
Immunfunktion
Über 80 % des Immunsystems befinden sich im Darm, und ein vielfältiges Mikrobiom spielt eine Schlüsselrolle bei der Schulung von Immunzellen, um angemessen zu reagieren. InnerBuddies hilft den Benutzern, die Fähigkeit ihres Mikrobioms zu bewerten, das Immunsystem auszugleichen und widerstandsfähiger zu machen.
Eine geringe mikrobielle Vielfalt oder das Vorhandensein entzündlicher Bakterien kann auf ein geschwächtes Abwehrsystem hinweisen. InnerBuddies liefert maßgeschneiderte Vorschläge – wie entzündungshemmende Lebensmittel oder immunstärkende Nährstoffe –, um eine stärkere und ausgeglichenere Immunantwort aufzubauen.
-
Psychische Gesundheit & Stimmung (Darm-Hirn-Achse)
Neue Forschungen zeigen, dass Ihr Mikrobiom Neurotransmitter wie Serotonin, Dopamin und GABA beeinflusst und so direkt Stimmung und Stresslevel beeinträchtigt. InnerBuddies untersucht Marker der Darm-Hirn-Achse, um zu erforschen, wie Ihre Mikroben Ihre mentale Gesundheit beeinflussen könnten.
Mit Einblicken in Bakterienstämme, die mit Angstzuständen, Depressionen oder Stressresistenz verbunden sind, kann InnerBuddies personalisierte Strategien vorschlagen, um emotionales Gleichgewicht zu fördern – von ballaststoffreichen Diäten bis hin zu psychobiotischen Nahrungsergänzungsmitteln.
-
Gewichtsmanagement & Stoffwechsel
Bestimmte Darmbakterien können mehr Energie aus der Nahrung gewinnen und die Fettansammlung, Insulinempfindlichkeit und Appetithormone beeinflussen. InnerBuddies analysiert Stoffwechselmarker in Ihrem Mikrobiom-Profil, um zu zeigen, wie Ihr Darm Ihr Gewicht beeinflussen könnte.
Mit gezielten Empfehlungen zu Lebensmitteln, die einen gesunden Stoffwechsel unterstützen – wie resistente Stärke oder polyphenolreiche Pflanzen – ermöglicht InnerBuddies den Nutzern, mikrobiell fundierte Entscheidungen zu treffen, die ihre Gesundheitsziele und Strategien zur Gewichtsregulierung ergänzen.
-
Hautgesundheit
Hautzustände wie Akne, Ekzem und Rosacea werden zunehmend mit Darmungleichgewichten und systemischer Entzündung in Verbindung gebracht. InnerBuddies analysiert Ihr Mikrobiom, um Muster zu erkennen, die möglicherweise zu entzündlichen Hautreaktionen beitragen.
Durch die Unterstützung der Integrität der Darmbarriere und die Reduzierung von pro-inflammatorischen Mikroben können die Empfehlungen von InnerBuddies helfen, die Haut von innen heraus zu verbessern – für ein klareres Hautbild und weniger Schübe durch das Bewusstsein für die Darm-Haut-Achse.
-
Personalisierte Ernährung
Nicht alle Lebensmittel sind für jedes Mikrobiom vorteilhaft. InnerBuddies liefert personalisierte Ernährungsempfehlungen basierend auf Ihrem einzigartigen mikrobiellen Profil – dabei werden Lebensmittel identifiziert, die nützliche Bakterien fördern und solche, die Dysbiose auslösen könnten.
Dieser individualisierte Ansatz hilft den Nutzern, über pauschale Diäten hinauszugehen und darmfreundliche Ernährungsstrategien zu übernehmen. Ob Sie Ihre Energie, Verdauung oder Langlebigkeit optimieren möchten, InnerBuddies verwandelt Ihre Mikrobiom-Daten in umsetzbare Ernährungspläne.
Hören Sie von unseren zufriedenen Kunden!
-
"Ich möchte dir mitteilen, wie aufgeregt ich bin. Wir waren etwa zwei Monate lang auf dieser Diät (mein Mann isst mit uns). Wir fühlten uns damit besser, aber wie viel besser wurde erst wirklich während der Weihnachtsferien bemerkt, als wir ein großes Weihnachtspaket erhalten hatten und für eine Weile nicht an der Diät festgehalten haben. Nun, das gab wieder Motivation, denn was für ein Unterschied in den gastrointestinalen Symptomen, aber auch in unserer Energie bei uns beiden!"
- Manon, 29 Jahre alt -
-
"Super hilfreich!!! Ich war schon auf dem richtigen Weg, aber jetzt weiß ich genau, was ich essen und trinken sollte und was nicht. Ich habe so lange mit Magen- und Darmproblemen gekämpft, hoffentlich kann ich sie jetzt loswerden."
- Petra, 68 Jahre -
-
"Ich habe Ihren umfassenden Bericht und Ihre Ratschläge gelesen. Vielen Dank dafür, sehr informativ. In dieser Form präsentiert, kann ich sicherlich damit fortfahren. Daher keine neuen Fragen für jetzt. Ich werde Ihre Vorschläge gerne beherzigen. Und viel Glück bei Ihrer wichtigen Arbeit."
- Dirk, 73 Jahre -