Inflamação e o Microbioma Intestinal: Como os Micro-organismos Moldam a Saúde e a Doença do Intestino




Encontre mais detalhes sobre Inflamação
-
>>
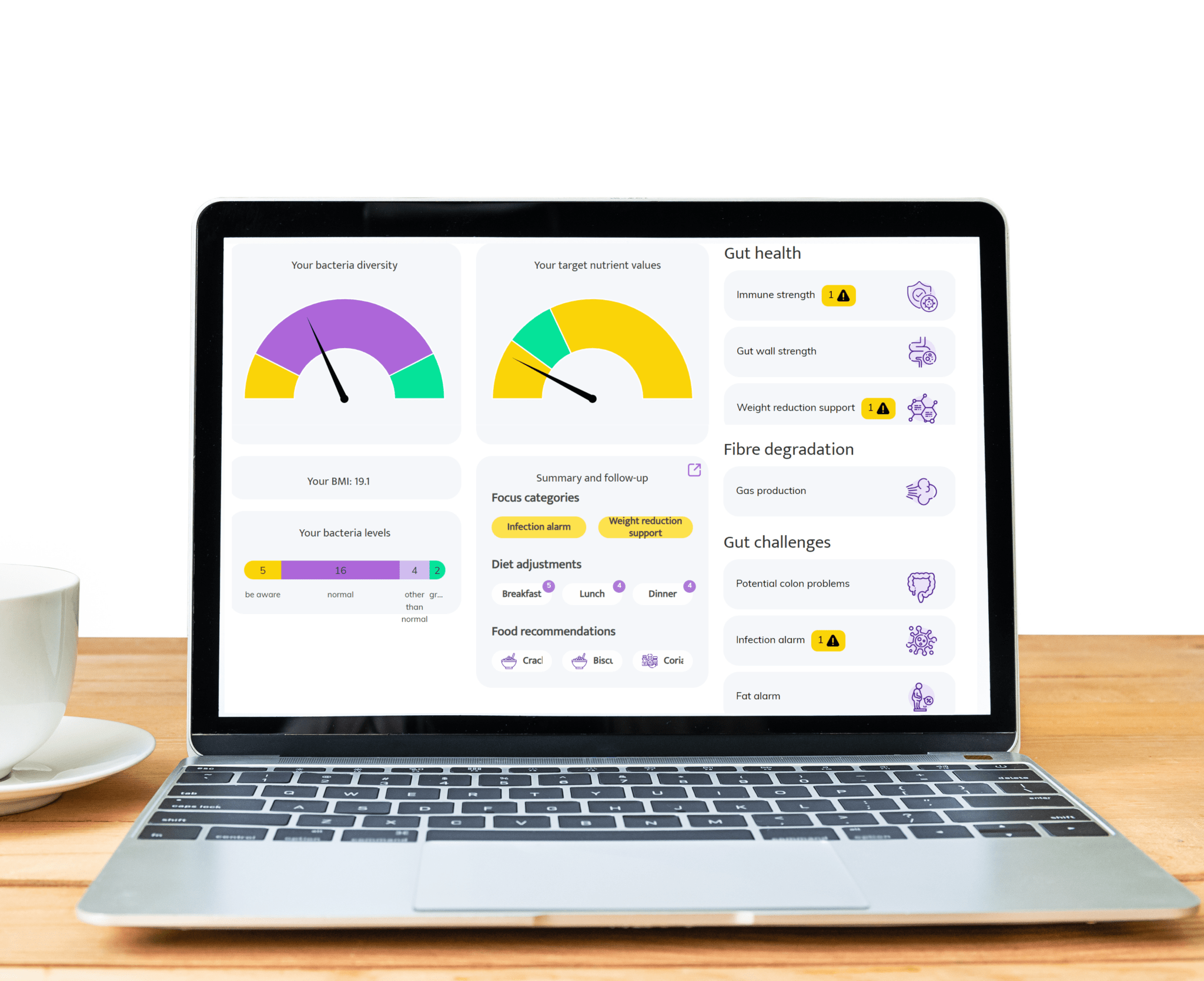
Teste de Inflamação Intestinal: Descobrindo informações sobre o seu microbioma intestinal e Melhorando a saúde intestinal
>Decifrando os Níveis de Calprotectina: Revelando insights sobre Inflamação na Saúde do Intestino e Análise do Microbioma
>Marcadores de Inflamação Intestinal: Perspectivas sobre o Microbioma Intestinal e Inflamação para uma Melhor Saúde do Intestino
>Compreendendo a Inflamação Crônica do Intestino: Uma Chave para o Equilíbrio da Microbiota Intestinal e a Saúde Ótima do Intestino
>Compreendendo a Inflamação de Baixo Grau no Intestino: Seu Impacto na Saúde Intestinal e no Microbioma
>Compreendendo a Inflamação e a Disbiose: Ideias Chave sobre Desequilíbrios na Microbiota Intestinal e Seu Impacto nos Sintomas de Saúde do Intestino
>Desvendando os Insights do Microbioma Intestinal: Ativação Imune e Inflamação em Sintomas e Condições de Saúde Intestinal
Inflamação & Ácidos Gordos de Cadeia Curta: Desvendando os Segredos do Microbioma Intestinal para a Saúde do Intestino e Alívio da Inflamação
Leia mais: Inflamação e a Microbiota Gut - Ligações com Sintomas e Condições de Saúde do Intestino
Áreas onde os testes do microbioma intestinal InnerBuddies podem ter um impacto significativo
-
Saúde Digestiva
Desconforto intestinal, como inchaço, obstipação, gases ou diarreia, muitas vezes resulta de um desequilíbrio nas bactérias intestinais. A InnerBuddies analisa a composição e diversidade do seu microbioma intestinal, identificando desequilíbrios específicos, como baixa quantidade de bactérias fermentadoras de fibras ou crescimento excessivo de microrganismos produtores de gases.
Ao identificar as causas principais dos problemas digestivos, a InnerBuddies fornece recomendações personalizadas e baseadas em evidências para apoiar a digestão. Seja através de mudanças alimentares direcionadas, prebióticos ou probióticos, os utilizadores podem tomar medidas práticas para restaurar o equilíbrio e melhorar o conforto gastrointestinal.
-
Função Imunitária
Mais de 80% do sistema imunitário reside no intestino, e um microbioma diversificado desempenha um papel fundamental ao treinar as células imunológicas para responderem de forma adequada. O InnerBuddies ajuda os utilizadores a avaliar a capacidade do seu microbioma de apoiar o equilíbrio e a resiliência do sistema imunitário.
Uma baixa diversidade microbiana ou a presença de bactérias inflamatórias podem indicar um sistema de defesa enfraquecido. O InnerBuddies fornece sugestões personalizadas — como alimentos anti-inflamatórios ou nutrientes que apoiam o sistema imunitário — para ajudar a construir uma resposta imunitária mais forte e equilibrada.
-
Saúde Mental & Humor (Eixo Intestino-Cérebro)
Investigação recente demonstra que o seu microbioma influencia neurotransmissores como a serotonina, dopamina e GABA, afetando diretamente o humor e os níveis de stress. A InnerBuddies avalia marcadores do eixo intestino-cérebro para explorar como os seus microrganismos podem estar a impactar o seu bem-estar mental.
Com informações sobre estirpes bacterianas associadas à ansiedade, depressão ou resiliência ao stress, a InnerBuddies pode orientar estratégias personalizadas para ajudar a melhorar o equilíbrio emocional — desde dietas ricas em fibra até suplementos psicobióticos.
-
Gestão de Peso & Metabolismo
Certas bactérias intestinais conseguem extrair mais energia dos alimentos e influenciar o armazenamento de gordura, a sensibilidade à insulina e as hormonas do apetite. A InnerBuddies avalia marcadores metabólicos no seu perfil de microbioma para ajudar a revelar como o seu intestino pode estar a impactar o seu peso.
Com conselhos personalizados sobre alimentos que promovem um metabolismo saudável—como amidos resistentes ou plantas ricas em polifenóis—a InnerBuddies capacita os utilizadores a tomar decisões informadas pela microbiota que complementam os seus objetivos de saúde e estratégias de controlo de peso.
-
Saúde da Pele
Condições de pele como acne, eczema e rosácea estão cada vez mais associadas a desequilíbrios intestinais e inflamação sistémica. A InnerBuddies analisa o seu microbioma para detetar padrões que podem contribuir para respostas inflamatórias da pele.
Ao apoiar a integridade da barreira intestinal e reduzir microrganismos pró-inflamatórios, as recomendações da InnerBuddies podem ajudar a melhorar a pele de dentro para fora—promovendo uma tez mais clara e menos surtos através da consciência do eixo intestino-pele.
-
Nutrição Personalizada
Nem todos os alimentos são benéficos para todos os intestinos. A InnerBuddies oferece informações nutricionais personalizadas com base no seu perfil microbiano único—identificando alimentos que nutrem bactérias benéficas e sinalizando aqueles que podem desencadear disbiose.
Esta abordagem personalizada ajuda os utilizadores a irem além das dietas universais e a adotarem estratégias nutricionais amigas do intestino. Quer esteja a otimizar energia, digestão ou longevidade, a InnerBuddies transforma os seus dados do microbioma em planos de refeições práticos.
Ouça os nossos clientes satisfeitos!
-
Gostaria de partilhar o quanto estou entusiasmada. Já seguimos a dieta há cerca de dois meses (o meu marido também come connosco). Sentimo-nos melhor com ela, mas só percebemos o quanto realmente melhorámos durante as férias de Natal, quando recebemos um grande pacote de Natal e não seguimos a dieta durante algum tempo. Bem, isso voltou a dar motivação, porque que diferença nos sintomas gastrointestinais, mas também na energia de ambos!
- Manon, 29 anos -
-
Super ajuda!!! Eu já estava no bom caminho, mas agora sei exatamente o que devo e não devo comer e beber. Tenho tido problemas com o estômago e os intestinos há tanto tempo, espero conseguir livrar-me disso agora.
- Petra, 68 anos -
-
Li o seu relatório e conselhos abrangentes. Muito obrigado por isso, foi muito informativo. Apresentado desta forma, posso certamente avançar com ele. Portanto, não tenho novas questões de momento. Ficarei feliz em considerar as suas sugestões. E boa sorte com o seu trabalho importante.
- Dirk, 73 anos -