Inflamación y la Microbiota Intestinal: Cómo los Microbios Moldean la Salud y Enfermedad del Intestino




Encuentra más detalles sobre Inflamación
-
>>
Prueba de inflamación intestinal: Descubre información sobre tu microbioma intestinal y mejora tu salud intestinal
>Descifrando los niveles de calprotectina: revelando información sobre la inflamación en la salud intestinal y el análisis del microbioma
>Marcadores inflamatorios intestinales: perspectivas sobre el microbioma intestinal y la inflamación para una mejor salud intestinal
>Comprendiendo la inflamación crónica del intestino: una clave para el equilibrio del microbioma intestinal y una salud intestinal óptima
>Comprendiendo la inflamación intestinal de bajo grado: su impacto en la salud intestinal y el microbioma
>Comprendiendo la inflamación y la disbiosis: ideas clave sobre los desequilibrios en el microbioma intestinal y su impacto en los síntomas de salud intestinal
>Descifrando conocimientos sobre el microbioma intestinal: activación inmunitaria y inflamación en los síntomas y condiciones de la salud intestinal
Inflamación y Ácidos Grasos de Cadena Corta (AGCC): Revelando conocimientos sobre el microbioma intestinal para la salud intestinal y el alivio de la inflamación
Leer más: Inflamación y el microbioma intestinal - Enlaces a síntomas y condiciones de la salud intestinal
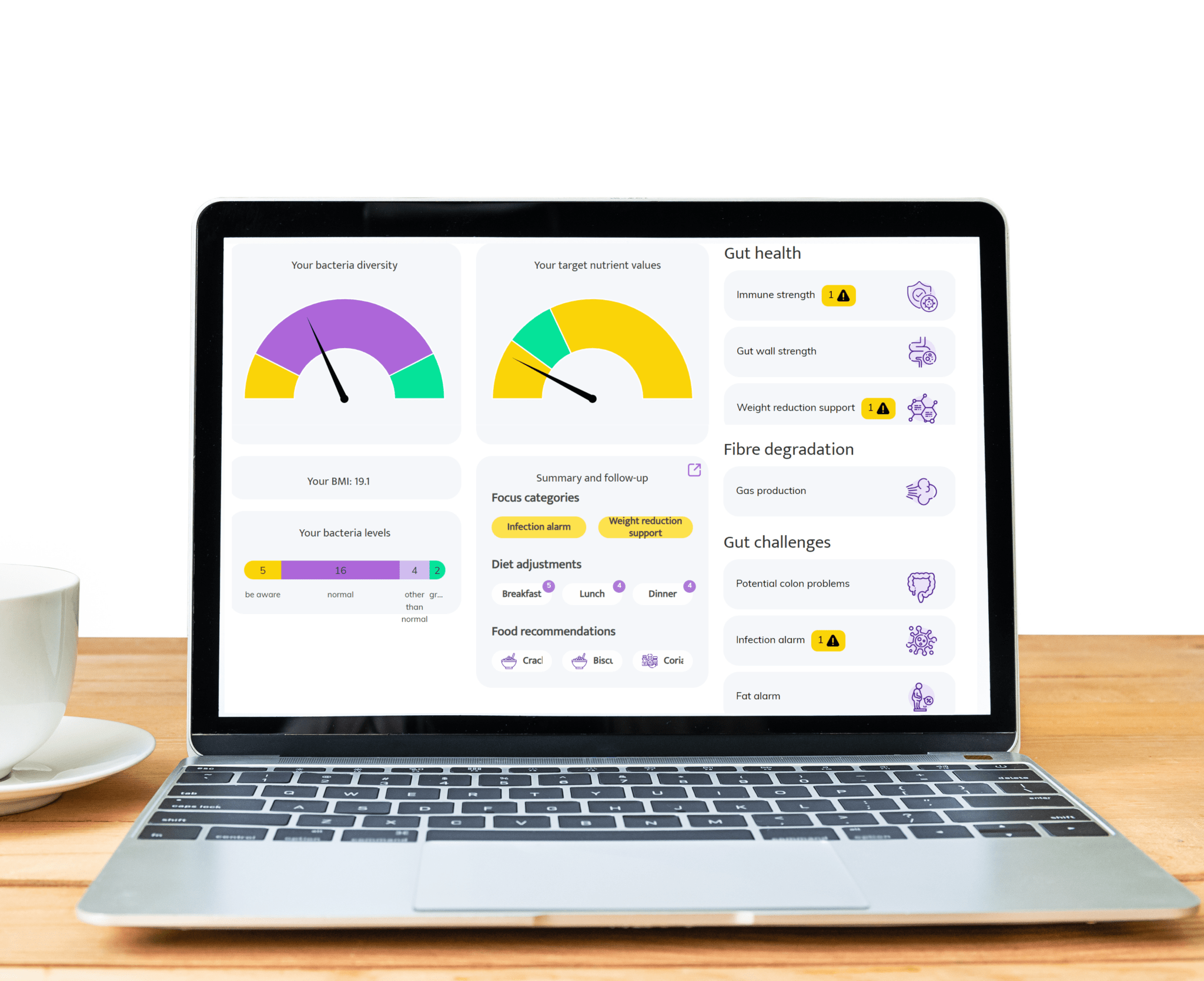
Áreas donde las pruebas de microbioma intestinal de InnerBuddies pueden tener un impacto significativo
-
Salud Digestiva
El malestar intestinal como hinchazón, estreñimiento, gases o diarrea a menudo se debe a un desequilibrio en las bacterias intestinales. InnerBuddies analiza la composición y diversidad de tu microbioma intestinal, identificando desequilibrios específicos, como una baja cantidad de bacterias que fermentan fibra o un crecimiento excesivo de microbios productores de gas.
Al identificar las causas principales de los problemas digestivos, InnerBuddies proporciona recomendaciones personalizadas y basadas en evidencia para apoyar la digestión. Ya sea a través de cambios dietéticos específicos, prebióticos o probióticos, los usuarios pueden tomar medidas concretas para restaurar el equilibrio y mejorar el confort gastrointestinal.
-
Función Inmune
Más del 80% del sistema inmunológico reside en el intestino, y un microbioma diverso juega un papel clave en el entrenamiento de las células inmunitarias para que respondan de manera adecuada. InnerBuddies ayuda a los usuarios a evaluar la capacidad de su microbioma para apoyar el equilibrio y la resiliencia inmunológica.
Una baja diversidad microbiana o la presencia de bacterias inflamatorias pueden indicar un sistema de defensa debilitado. InnerBuddies ofrece sugerencias personalizadas, como alimentos antiinflamatorios o nutrientes que apoyan el sistema inmunológico, para ayudar a construir una respuesta inmunológica más fuerte y equilibrada.
-
Salud Mental y Estado de Ánimo (Eje Intestino-Cerebro)
Investigaciones emergentes muestran que tu microbioma influye en neurotransmisores como la serotonina, la dopamina y el GABA, afectando directamente el estado de ánimo y los niveles de estrés. InnerBuddies evalúa marcadores del eje intestino-cerebro para explorar cómo tus microbios pueden estar impactando tu bienestar mental.
Con información sobre cepas bacterianas asociadas con ansiedad, depresión o resiliencia al estrés, InnerBuddies puede guiar estrategias personalizadas para ayudar a mejorar el equilibrio emocional, desde dietas ricas en fibra hasta suplementos psicobióticos.
-
Gestión del Peso y Metabolismo
Ciertas bacterias intestinales pueden extraer más energía de los alimentos e influir en el almacenamiento de grasa, la sensibilidad a la insulina y las hormonas del apetito. InnerBuddies evalúa marcadores metabólicos en tu perfil de microbioma para ayudar a revelar cómo tu intestino puede estar impactando tu peso.
Con consejos personalizados sobre alimentos que apoyan un metabolismo saludable, como almidones resistentes o plantas ricas en polifenoles, InnerBuddies capacita a los usuarios para tomar decisiones informadas microbiológicamente que complementen sus objetivos de salud y estrategias de control de peso.
-
Salud de la Piel
Afecciones de la piel como el acné, la dermatitis atópica y la rosácea están cada vez más relacionadas con desequilibrios intestinales e inflamación sistémica. InnerBuddies analiza tu microbioma para detectar patrones que pueden contribuir a respuestas inflamatorias en la piel.
Al apoyar la integridad de la barrera intestinal y reducir los microbios proinflamatorios, las recomendaciones de InnerBuddies pueden ayudar a mejorar la piel desde adentro hacia afuera, fomentando un cutis más claro y menos brotes a través de la conciencia del eje intestino-piel.
-
Nutrición Personalizada
No todos los alimentos son beneficiosos para cada intestino. InnerBuddies ofrece información nutricional personalizada basada en tu perfil microbiano único, identificando alimentos que nutren las bacterias beneficiosas y marcando aquellos que pueden desencadenar disbiosis.
Este enfoque personalizado ayuda a los usuarios a superar las dietas generales y adoptar estrategias de nutrición amigables con el intestino. Ya sea que estés optimizando para energía, digestión o longevidad, InnerBuddies transforma tus datos del microbioma en planes de comidas accionables.
¡Escucha a nuestros clientes satisfechos!
-
"Me gustaría hacerte saber lo emocionada que estoy. Hemos estado en la dieta durante aproximadamente dos meses (mi esposo come con nosotras). Nos sentimos mejor con ella, pero cuánto mejor solo lo notamos realmente durante las vacaciones de Navidad cuando recibimos un gran paquete de Navidad y no seguimos la dieta por un tiempo. Bueno, eso nos motivó de nuevo, ¡porque qué diferencia en los síntomas gastrointestinales pero también en la energía en ambos!"
- Manon, 29 años -
-
"¡Ayuda super!!! Ya estaba bastante avanzada, pero ahora sé con certeza qué debo y no debo comer ni beber. He estado luchando con el estómago y los intestinos durante tanto tiempo, espero poder deshacerme de estos problemas ahora."
- Petra, de 68 años -
-
"He leído su informe completo y sus consejos. Muchas gracias por ello, es muy informativo. Presentado de esta manera, ciertamente puedo avanzar con ello. Por lo tanto, no hay nuevas preguntas por ahora. Agradeceré mucho tener en cuenta sus sugerencias. Y mucha suerte en su importante trabajo."
- Dirk, de 73 años -