Zapalenie i mikrobiom jelitowy: jak mikroby kształtują zdrowie jelit oraz choroby




Znajdź więcej informacji o Stan zapalny
-
>>
Test zapalenia jelita: odblokuj wgląd w mikroflorę jelitową i popraw zdrowie jelit
>Odczytywanie poziomów kalprotektyny: ujawnianie informacji o stanach zapalnych w zdrowiu jelit i analizie mikrobiomu
>Markery zapalenia jelit: Wgląd w mikrobiom jelitowy i stan zapalny dla lepszego zdrowia jelit
>Zrozumienie przewlekłego zapalenia jelit: klucz do równowagi mikrobiomu jelitowego i optymalnego zdrowia jelit
>Zrozumienie niskiego stopnia stanów zapalnych jelit: ich wpływ na zdrowie jelit i mikrobiom
>Zrozumienie stanu zapalnego i dysbiozy: Kluczowe informacje na temat zaburzeń mikrobiomu jelitowego i ich wpływu na objawy zdrowia jelit
>Odkrywanie tajemnic mikrobiomu jelitowego: aktywacja układu odpornościowego i stan zapalny w objawach i schorzeniach zdrowia jelit
Zapalenie i SKA: Odkrywanie informacji o mikrobiomie jelitowym dla zdrowia jelit i łagodzenia stanów zapalnych
Czytaj więcej: Zapalenie i mikrobiom jelitowy – związki z objawami i stanami zdrowotnymi jelit
Obszary, w których testowanie mikrobiomu jelit przez InnerBuddies może mieć znaczący wpływ
-
Zdrowie trawiienne
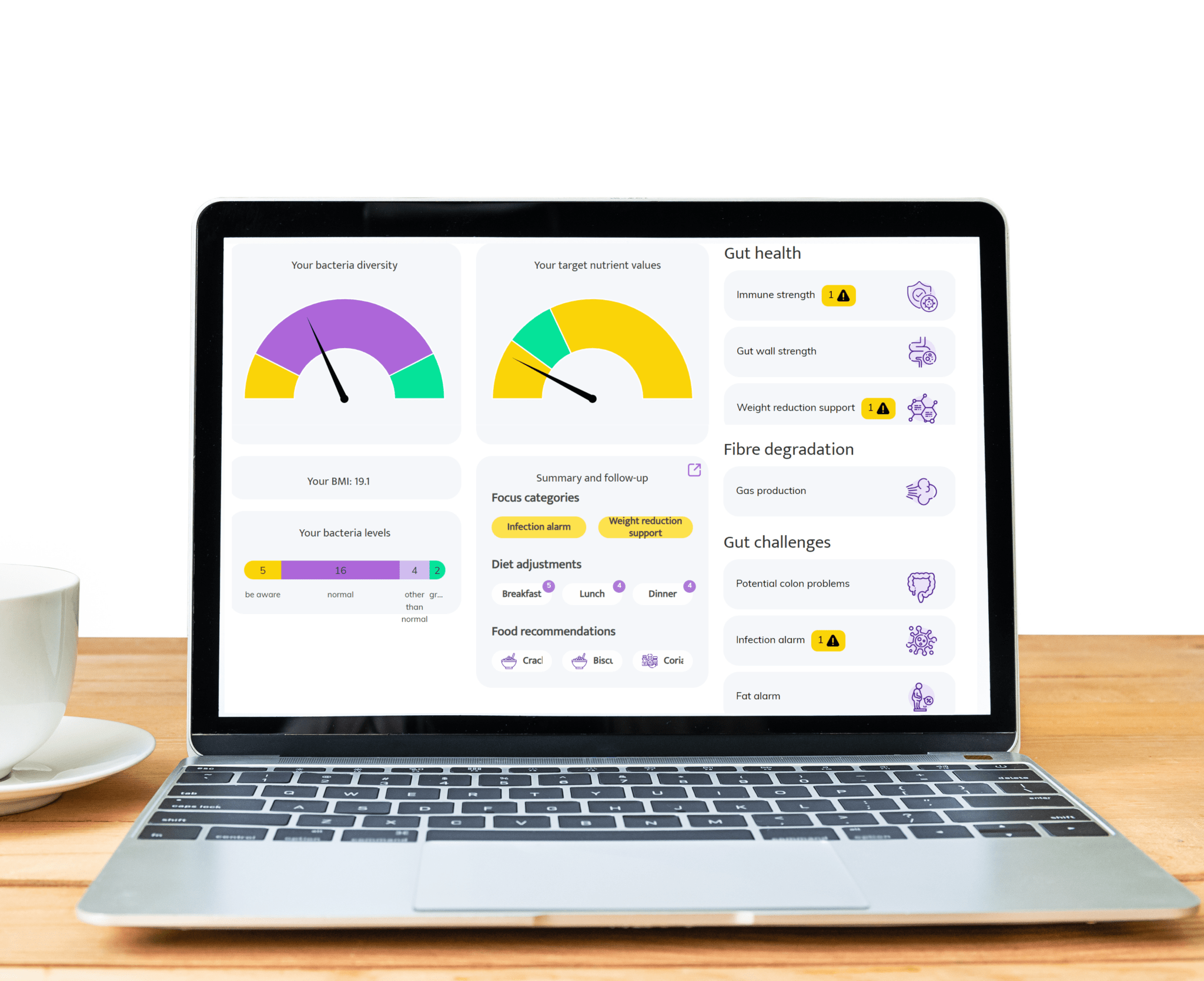
Dyskomfort jelitowy, taki jak wzdęcia, zaparcia, gazowanie czy biegunka, często wynika z nieprawidłowego balansu bakterii jelitowych. InnerBuddies analizuje skład i różnorodność mikrobiomu jelitowego, identyfikując konkretne zaburzenia, takie jak niska liczba bakterii fermentujących włókno lub nadmierny wzrost mikroorganizmów produkujących gazy.
Wykrywając przyczyny problemów trawiennych, InnerBuddies dostarcza spersonalizowane, oparte na dowodach rekomendacje wspierające trawienie. Dzięki celowym zmianom w diecie, prebiotykom lub probiotykom użytkownicy mogą podjąć konkretne działania, aby przywrócić równowagę i poprawić komfort układu pokarmowego.
-
Funkcje odpornościowe
Ponad 80% układu odpornościowego znajduje się w jelitach, a zróżnicowany mikrobiom odgrywa kluczową rolę w szkoleniu komórek odpornościowych do odpowiedniej reakcji. InnerBuddies pomaga użytkownikom ocenić zdolność ich mikrobiomu do wspierania równowagi i odporności układu immunologicznego.
Niska różnorodność mikroorganizmów lub obecność bakterii zapalnych może wskazywać na osłabiony system obronny. InnerBuddies dostarcza spersonalizowane sugestie – takie jak pokarmy przeciwzapalne czy składniki odżywcze wspierające odporność – aby pomóc wzbudzić silniejszą i bardziej zrównoważoną odpowiedź immunologiczną.
-
Zdrowie psychiczne i nastrój (oś jelita-mózgu)
Najnowsze badania pokazują, że mikrobiom wpływa na neurotransmitery takie jak serotonina, dopamina i GABA, bezpośrednio wpływając na nastrój i poziom stresu. InnerBuddies ocenia markery osi jelitowo-mózgowej, aby zbadać, w jaki sposób Twoje mikroorganizmy mogą wpływać na dobre samopoczucie psychiczne.
Dzięki wglądowi w szczepy bakterii związane z lękiem, depresją lub odpornością na stres, InnerBuddies może pomóc w opracowaniu spersonalizowanych strategii poprawy równowagi emocjonalnej – od diet bogatych w błonnik po suplementy psychobiotyczne.
-
Zarządzanie wagą i metabolizm
Pewne bakterie jelitowe mogą wydobywać więcej energii z pożywienia i wpływać na magazynowanie tłuszczu, wrażliwość na insulinę oraz hormony odpowiadające za apetyt. InnerBuddies ocenia markery metaboliczne w profilu Twojego mikrobiomu, aby pomóc ujawnić, jak Twój układ pokarmowy może wpływać na Twoją wagę.
Dzięki spersonalizowanej poradzie dotyczącej pokarmów wspierających zdrowy metabolizm — takich jak skrobia oporna czy rośliny bogate w polifenole — InnerBuddies daje użytkownikom możliwość podejmowania decyzji uwzględniających mikrobiom, które wspierają ich cele zdrowotne i strategie zarządzania wagą.
-
Zdrowie skóry
Problemy skórne, takie jak trądzik, ekcema i rumień, są coraz częściej związane z zaburzeniami jelitowymi i ogólnoustrojowym stanem zapalnym. InnerBuddies analizuje Twoją mikrobiom, aby wykryć wzorce, które mogą przyczyniać się do zapalnych reakcji skóry.
Poprzez wspieranie integralności bariery jelitowej i redukcję prozapalnych mikrobów, rekomendacje od InnerBuddies mogą pomóc poprawić skórę od środka – zachęcając do jaśniejszego odcienia i mniejszej liczby nawrotów dzięki świadomości osi jelitowo-skórnej.
-
Spersonalizowana dieta
Nie wszystkie pokarmy są korzystne dla każdego jelita. InnerBuddies dostarcza spersonalizowane spostrzeżenia dotyczące odżywiania na podstawie unikalnego profilu mikrobiologicznego – identyfikując pokarmy, które zasilają korzystne bakterie i sygnalizując te, które mogą wywołać dysbiozę.
Ta spersonalizowana metoda pomaga użytkownikom wyjść poza diety uniwersalne i przyjąć strategie żywienia przyjazne dla jelit. Niezależnie od tego, czy optymalizujesz swoją dietę pod kątem energii, trawienia czy długowieczności, InnerBuddies przekształca dane o mikrobiomie w praktyczne plany posiłków.
Posłuchaj zadowolonych klientów!
-
„Chciałbym powiedzieć, jak bardzo jestem podekscytowany. Byliśmy na diecie około dwóch miesięcy (mój mąż je z nami). Czuliśmy się lepiej, ale jak bardzo, zauważyliśmy dopiero podczas świąt Bożego Narodzenia, kiedy dostaliśmy duży pakunek świąteczny i przez pewien czas nie przestrzegaliśmy diety. To naprawdę dodatkowo zmobilizowało nas, ponieważ jaka była różnica w objawach ze strony przewodu pokarmowego, ale także w naszej energii!”
- Manon, lat 29 -
-
"Super pomoc!!! Już byłam na dobrej drodze, ale teraz na pewno wiem, co powinnam jeść i pić, a czego nie. Miałam problemy z żołądkiem i jelitami przez długi czas, mam nadzieję, że teraz się ich pozbędę."
- Petra, 68 lat -
-
"Przeczytałem Twój obszerny raport i porady. Dziękuję za to bardzo, jest to bardzo pouczające. Przedstawione w ten sposób, mogę na pewno ruszyć z tym do przodu. Dlatego na razie nie mam nowych pytań. Chętnie wezmę Twoje sugestie do siebie. I powodzenia w ważnej pracy."
- Dirk, lat 73 -