Auto-immuunziekten en Darmgezondheid: De Rol van de Microbiomen bij Symptomen en Aandoeningen




Vind meer details over Auto-immuun
-
>>
Auto-immuun Darm Test: Ontdekking van Microbioom-inzichten voor Betere Auto-immuun Gezondheid
>Het ontsluiten van darmgezondheid: Het begrijpen van de rol van de Hashimoto-microbiomen in auto-immuunziekten
>Inzicht in de microbiomen bij reumatoïde artritis: het ontsluiten van darmgezondheid voor oplossingen bij auto-immuunzorg
>Het ontgrendelen van de verbinding: Hoe darmbacteriën invloed hebben op lupus en auto-immuunziekten
>Het onthullen van de connectie: Multiple sclerose en de darmmicrobioom in de auto-immuun darmgezondheid
>IBD versus IBS: Begrijpen van microbiomemutaties bij auto-immuun darmgezondheid
>Het ontgrendelen van de darmmicrobioom: verkennen van de rol ervan in de ziekte van Crohn en auto-immuunmaaggezondheid
Inzicht in het Ulceratieve Colitis Darmmicrobioom: Verkenningen van Auto-immuun Darmgezondheid & Aandoeningen
Lees verder: Auto-immuungezondheid in de Darm – De rol van de microbioto bij symptomen en aandoeningen
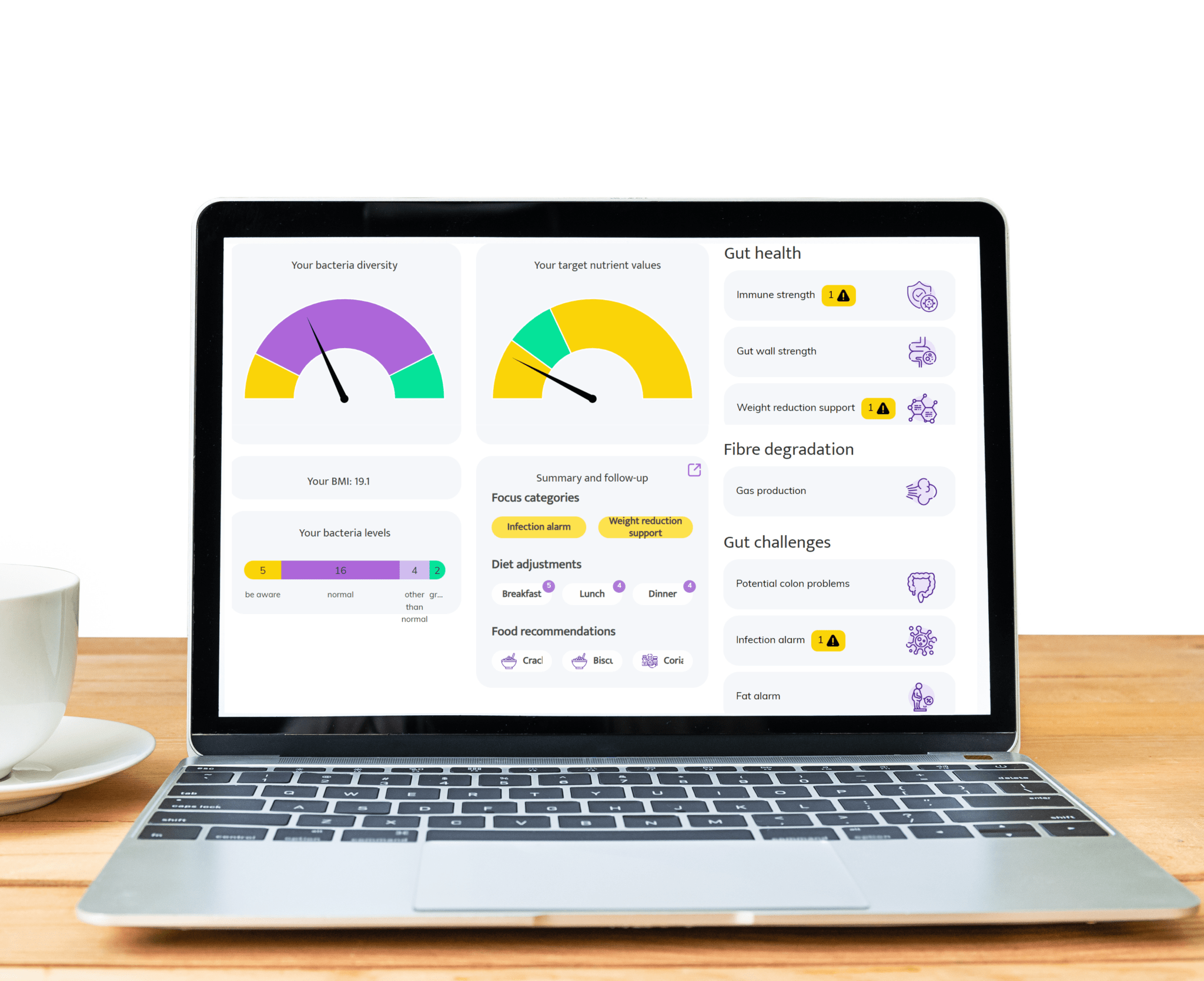
Gebieden waar InnerBuddies darmmicrobioomtest een significante impact kan hebben
-
Spijsverteringsgezondheid
Buikklachten zoals opgeblazenheid, verstopping, gas of diarree ontstaan vaak door een onevenwicht in de darmbacteriën. InnerBuddies analyseert de samenstelling en diversiteit van je darmmicrobiom en identificeert specifieke onevenwichten, zoals een te laag gehalte aan vezelverterende bacteriën of een overgroei van gasproducerende micro-organismen.
Door de oorzaken van spijsverteringsproblemen nauwkeurig te bepalen, biedt InnerBuddies gepersonaliseerde, op bewijs gebaseerde aanbevelingen om de spijsvertering te ondersteunen. Of dit nu gebeurt door gerichte dieetwijzigingen, prebiotica of probiotica, gebruikers kunnen concrete stappen ondernemen om harmonie te herstellen en de comfort van het maag-darmstelsel te verbeteren.
-
Immuunsysteemfunctie
Meer dan 80% van het immuunsysteem bevindt zich in de darmen, en een diverse microbiom speelt een belangrijke rol bij het trainen van immuuncellen om adequaat te reageren. InnerBuddies helpt gebruikers hun microbiom te evalueren op zijn vermogen om immunologisch evenwicht en veerkracht te ondersteunen.
Een lage microbiele diversiteit of het aanwezig zijn van ontstekingsveroorzakende bacteriën kan erop wijzen dat het afweersysteem is verzwakt. InnerBuddies biedt gepersonaliseerde suggesties – zoals voedsel met ontstekingsremmende werking of voedingsstoffen die het immuunsysteem ondersteunen – om een sterker en meer gebalanceerd immuunantwoord te bevorderen.
-
Geestelijke gezondheid & stemming (Darm-hersen-as)
Nieuw onderzoek toont aan dat je microbiom invloed heeft op neurotransmitters zoals serotonine, dopamine en GABA, wat direct van invloed is op je stemming en stressniveau. InnerBuddies evalueert markers van de darm-hersenen-as om te onderzoeken hoe je micro-organismen je mentale welzijn kunnen beïnvloeden.
Met inzicht in bacteriële stammen die verband houden met angst, depressie of stressveerkracht, kan InnerBuddies persoonlijke strategieën aansturen om emotionele balans te verbeteren – variërend van vezelrijke diëten tot psychobiotische supplementen.
-
Gewichtsbeheer & metabolisme
Bepaalde darmbacteriën kunnen meer energie uit voedsel halen en invloed uitoefenen op vetopslag, insulinegevoeligheid en eetlusthormonen. InnerBuddies evalueert metabole markers in je microbiomenprofiel om te helpen onthullen hoe je darm je gewicht kan beïnvloeden.
Met op maat gemaakte adviezen over voedingsmiddelen die een gezonde stofwisseling ondersteunen—zoals resistente zetmeleiwitten of planten rijk aan polyfenolen—geeft InnerBuddies gebruikers de mogelijkheid om beslissingen te nemen die zijn gebaseerd op microbiële informatie, wat bijdraagt aan hun gezondheidsdoelen en strategieën voor gewichtsbeheer.
-
Huidgezondheid
Huidproblemen zoals acne, eczeem en rosacea worden steeds vaker in verband gebracht met een onevenwichtige darmflora en systemische ontstekingen. InnerBuddies analyseert je microbiom om patronen te detecteren die mogelijk bijdragen aan ontstekingsreacties van de huid.
Door de integriteit van de darmbarrière te ondersteunen en het aantal pro-inflammatoire micro-organismen te verminderen, kunnen de aanbevelingen van InnerBuddies helpen de huid van binnenuit te verbeteren – wat leidt tot een helderder teint en minder uitbarstingen door bewustzijn van de darm-huid-as.
-
Gepersonaliseerde voeding
Niet alle voedingsmiddelen zijn gunstig voor elke darm. InnerBuddies biedt gepersonaliseerde voedingsinzichten op basis van jouw unieke microbiële profiel – het identificeren van voedingsmiddelen die gunstige bacteriën voeden en waarschuwen voor die welke dysbiose kunnen veroorzaken.
Deze persoonlijke aanpak helpt gebruikers om voorbij de one-size-fits-all diëten te gaan en maakt plaats voor darmvriendelijke voedingsstrategieën. Of je nu optimaliseert voor energie, spijsvertering of een lange levensduur, InnerBuddies vertaalt jouw microbiomgegevens in concrete maaltijdplannen.
Hoor van onze tevreden klanten!
-
"Ik wil je laten weten hoe enthousiast ik ben. We deden al ongeveer twee maanden het dieet (mijn man eet mee met ons). We voelden ons er beter bij, maar hoeveel beter merkten we pas echt tijdens de kerstvakantie toen we een groot kerstpakket hadden ontvangen en niet meer zo strikt aan het dieet vasthielden. Nou, dat gaf weer motivatie, want wat een verschil in gastro-intestinale klachten maar ook in energie bij ons beiden!"
- Manon, 29 jaar -
-
"Super hulp!!! Ik was al een eind op weg, maar nu weet ik zeker wat ik wel en niet moet eten, drinken. Ik heb al zo lang last van mijn maag en darmen, hoop dat ik er nu vanaf kom."
- Petra, 68 jaar -
-
"Ik heb uw uitgebreide rapport en advies gelezen. Heel erg bedankt daarvoor, het was zeer informatief. Op deze manier gepresenteerd, kan ik er zeker mee verder. Dus voorlopig geen nieuwe vragen. Ik zal uw suggesties met alle plezier ter harte nemen. En veel succes met uw belangrijke werk."
- Dirk, 73 jaar -