Autoimmune e Salute Intestinale: Il Ruolo del Microbioma nei Sintomi e nelle Condizioni




Scopri ulteriori dettagli su Autoimmune
-
>>
Test autoimmune intestinale: Sbloccare le intuizioni sul microbioma intestinale per una migliore salute autoimmune
>Sbloccare la salute intestinale: comprendere il ruolo del microbioma di Hashimoto nelle condizioni autoimmuni
>Comprendere il microbioma dell'artrite reumatoide: Sbloccare soluzioni per la salute intestinale e il sollievo dalle malattie autoimmuni
>Sbloccare la Connessione: Come i Batteri Intestinali Influenzano il Lupus e le Malattie Autoimmuni
>Rivelare la Connessione: Sclerosi Multipla e il Microbioma Intestinale nella Salute Autoimmune dell'Intestino
>IBD contro IBS: Comprendere le Differenze del Microbioma nella Salute dell'Intestino Autoimmune
>Sbloccare il microbioma intestinale: esplorare il suo ruolo nella malattia di Crohn e nella salute autoimmune dell'intestino
Comprendere il microbioma intestinale della colite ulcerosa: approfondimenti sulla salute intestinale autoimmune e le condizioni ad essa correlate
Leggi di più: Salute autoimmune nell'intestino—il ruolo del microbioma nei sintomi e nelle condizioni
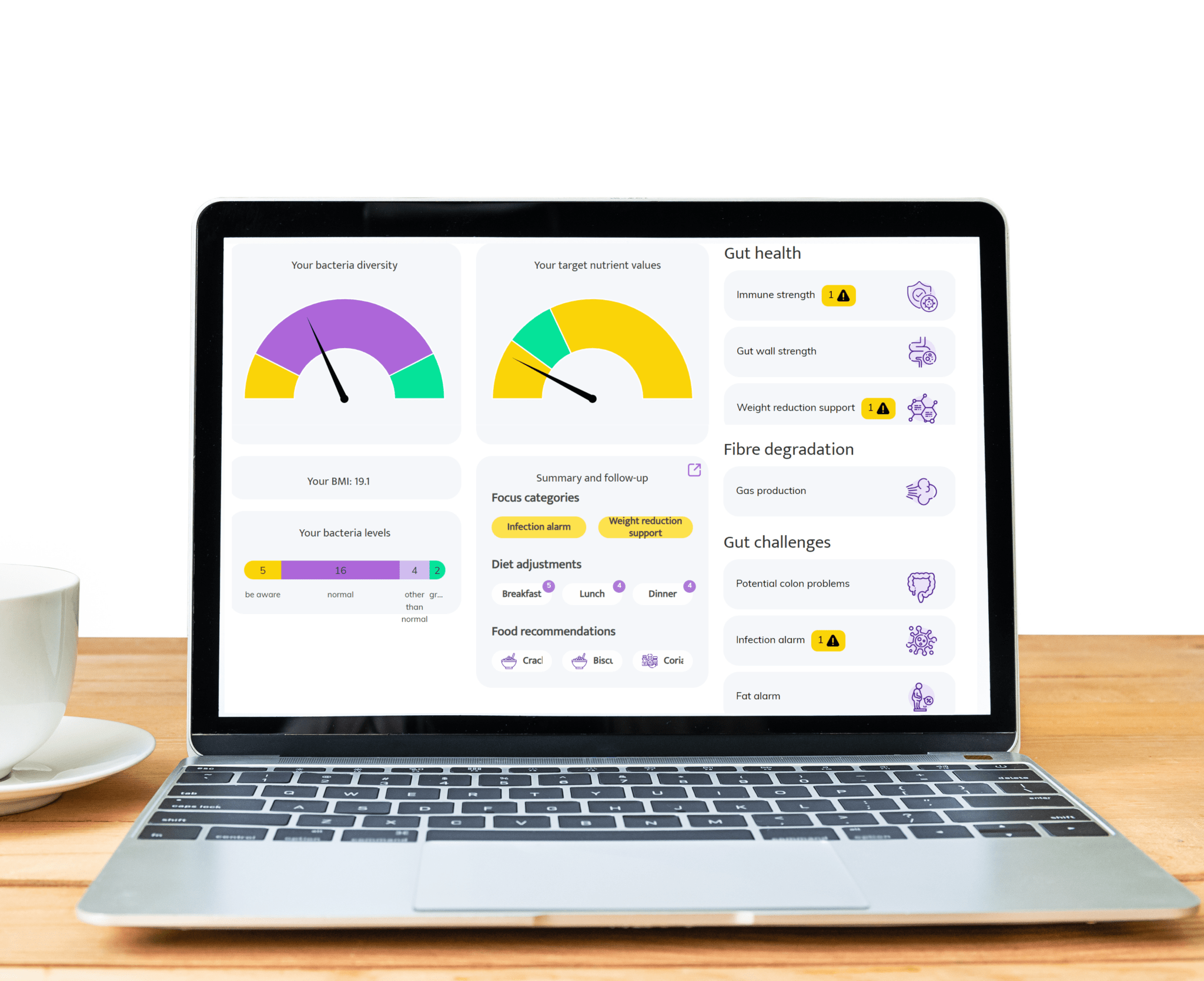
Aree in cui il test del microbioma intestinale InnerBuddies può avere un impatto significativo
-
Salute Digestiva
Il disagio intestinale come gonfiore, stitichezza, gas o diarrea spesso deriva da uno squilibrio nei batteri intestinali. InnerBuddies analizza la composizione e la diversità del tuo microbioma intestinale, identificando squilibri specifici come una bassa presenza di batteri fermentanti le fibre o una proliferazione eccessiva di microrganismi produttori di gas.
Individuando le cause principali dei problemi digestivi, InnerBuddies fornisce raccomandazioni personalizzate basate su prove scientifiche per supportare la digestione. Che sia attraverso cambiamenti mirati nella dieta, prebiotici o probiotici, gli utenti possono intraprendere azioni concrete per ripristinare l'equilibrio e migliorare il comfort gastrointestinale.
-
Funzione Immunitaria
Oltre l'80% del sistema immunitario risiede nell'intestino, e un microbioma diversificato svolge un ruolo chiave nel preparare le cellule immunitarie a rispondere in modo appropriato. InnerBuddies aiuta gli utenti a valutare la capacità del proprio microbioma di supportare l'equilibrio e la resilienza immunitaria.
Una bassa diversità microbica o la presenza di batteri infiammatori può indicare un sistema di difesa indebolito. InnerBuddies fornisce suggerimenti personalizzati – come alimenti antinfiammatori o nutrienti che supportano il sistema immunitario – per aiutare a costruire una risposta immunitaria più forte ed equilibrata.
-
Salute Mentale e Umore (Asse Intestino-Cervello)
Ricerche emergenti mostrano che il tuo microbioma influenza i neurotrasmettitori come la serotonina, la dopamina e il GABA, influenzando direttamente l'umore e i livelli di stress. InnerBuddies valuta i marcatori dell'asse intestino-cervello per esplorare come i tuoi microbi possano influire sul tuo benessere mentale.
Con una visione approfondita delle specie batteriche associate ad ansia, depressione o resilienza allo stress, InnerBuddies può guidare strategie personalizzate per aiutare a migliorare l'equilibrio emotivo, spaziando da diete ricche di fibre a integratori psicobiotici.
-
Gestione del Peso e Metabolismo
Certi batteri intestinali possono estrarre più energia dal cibo e influenzare l'accumulo di grasso, la sensibilità all'insulina e gli ormoni dell'appetito. InnerBuddies valuta i marcatori metabolici nel tuo profilo del microbioma per aiutare a rivelare come il tuo intestino potrebbe influire sul tuo peso.
Con consigli personalizzati su alimenti che supportano un metabolismo sano, come amidi resistenti o piante ricche di polifenoli, InnerBuddies permette agli utenti di prendere decisioni informate sul piano microbico che si integrano con i loro obiettivi di salute e strategie di gestione del peso.
-
Salute della Pelle
Condizioni cutanee come acne, eczema e rosacea sono sempre più legate a squilibri intestinali e infiammazione sistemica. InnerBuddies analizza il tuo microbioma per rilevare schemi che potrebbero contribuire a risposte infiammatorie della pelle.
Sostenendo l'integrità della barriera intestinale e riducendo i microbi pro-infiammatori, i suggerimenti di InnerBuddies possono aiutare a migliorare la pelle dall'interno verso l'esterno – favorendo un incarnato più chiaro e meno eruzioni cutanee attraverso la consapevolezza dell'asse intestino-pelle.
-
Nutrizione Personalizzata
Non tutti i cibi sono benefici per ogni intestino. InnerBuddies fornisce approfondimenti nutrizionali personalizzati basati sul tuo profilo microbico unico, identificando alimenti che nutrono i batteri benefici e segnalando quelli che potrebbero causare disbiosi.
Questo approccio personalizzato aiuta gli utenti a superare le diete universali e ad abbracciare strategie nutrizionali amiche dell'intestino. Che tu stia ottimizzando per l'energia, la digestione o la longevità, InnerBuddies trasforma i dati del tuo microbioma in piani pasto attuabili.
Ascolta i nostri clienti soddisfatti!
-
"Volevo farvi sapere quanto sono entusiasta. Siamo stati a dieta per circa due mesi (mio marito mangia con noi). Ci siamo sentiti meglio con essa, ma ci siamo resi conto di quanto meglio solo durante le vacanze di Natale, quando abbiamo ricevuto un grande pacco di Natale e non abbiamo seguito la dieta per un po'. Beh, questo ci ha dato nuovamente motivazione, perché che differenza nei sintomi gastrointestinali ma anche nell'energia di entrambi!"
- Manon, 29 anni -
-
"Aiuto super!!! Ero già sulla buona strada, ma ora so con certezza cosa devo e non devo mangiare, bere. Ho lottato con lo stomaco e l'intestino per così tanto tempo, spero di potermene liberare adesso."
- Petra, 68 anni -
-
"Ho letto il tuo rapporto completo e i consigli. Molte grazie per questo, molto informativo. Presentato in questo modo, posso certamente andare avanti con esso. Quindi nessuna nuova domanda per ora. Sarò lieto di tenere a mente i tuoi suggerimenti. E buona fortuna con il tuo importante lavoro."
- Dirk, 73 anni -