Déverrouiller la santé intestinale : Le rôle du microbiome de Hashimoto dans les maladies auto-immunes



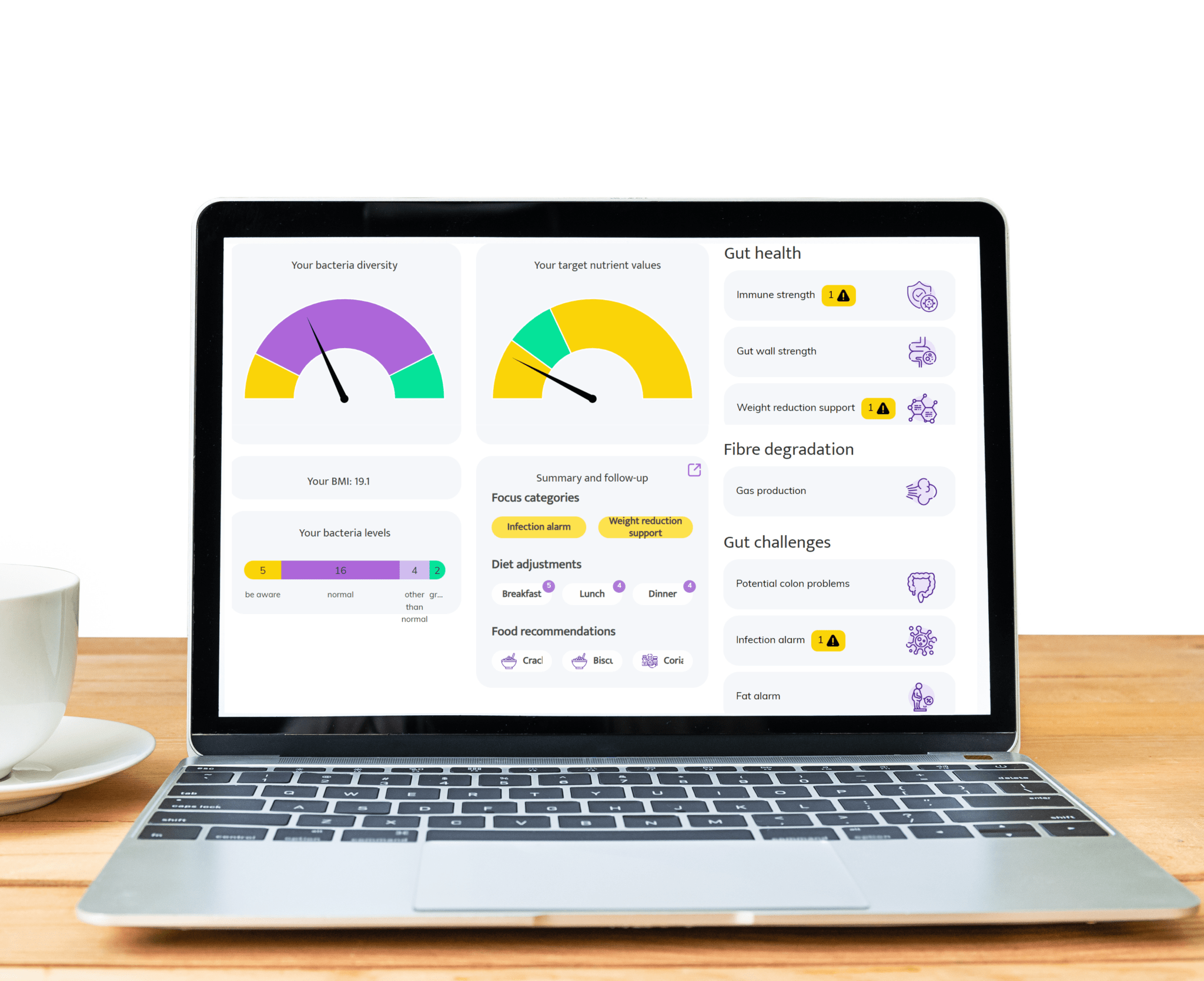

Lisez la suite : Déverrouiller la santé intestinale et le microbiome de Hashimoto dans les affections auto-immunes
Domaines où le test de microbiome intestinal InnerBuddies peut avoir un impact significatif
-
Santé digestive
Les désagréments intestinaux tels que les ballonnements, la constipation, les gaz ou la diarrhée proviennent souvent d'un déséquilibre dans les bactéries intestinales. InnerBuddies analyse la composition et la diversité de votre microbiome intestinal, identifiant des déséquilibres spécifiques comme une faible présence de bactéries fermentant les fibres ou une prolifération de microbes producteurs de gaz.
En identifiant les causes profondes des problèmes digestifs, InnerBuddies propose des recommandations personnalisées et basées sur des preuves pour soutenir la digestion. Que ce soit à travers des changements alimentaires ciblés, des prébiotiques ou des probiotiques, les utilisateurs peuvent prendre des mesures concrètes pour rétablir l'harmonie et améliorer le confort gastro-intestinal.
-
Fonction immunitaire
Plus de 80 % du système immunitaire réside dans l'intestin, et un microbiome divers joue un rôle clé dans l'apprentissage des cellules immunitaires pour qu'elles répondent de manière appropriée. InnerBuddies aide les utilisateurs à évaluer la capacité de leur microbiome à soutenir l'équilibre et la résilience immunitaire.
Une faible diversité microbienne ou la présence de bactéries inflammatoires peut indiquer un système de défense affaibli. InnerBuddies propose des suggestions personnalisées – comme des aliments anti-inflammatoires ou des nutriments favorisant l'immunité – pour aider à renforcer une réponse immunitaire plus forte et plus équilibrée.
-
Santé mentale et humeur (Axe intestin-cerveau)
Des recherches émergentes montrent que votre microbiome influence les neurotransmetteurs comme la sérotonine, la dopamine et le GABA, affectant directement l'humeur et les niveaux de stress. InnerBuddies évalue les marqueurs de l'axe intestin-cerveau pour explorer comment vos microbes peuvent impacter votre bien-être mental.
Avec une compréhension des souches bactériennes associées à l'anxiété, à la dépression ou à la résilience au stress, InnerBuddies peut guider des stratégies personnalisées pour aider à améliorer l'équilibre émotionnel — allant de régimes riches en fibres à des suppléments psychobiotiques.
-
Gestion du poids et métabolisme
Certaines bactéries intestinales peuvent extraire plus d'énergie des aliments et influencer le stockage des graisses, la sensibilité à l'insuline et les hormones de l'appétit. InnerBuddies évalue les marqueurs métaboliques dans votre profil de microbiome pour aider à révéler comment votre intestin peut avoir un impact sur votre poids.
Avec des conseils personnalisés sur les aliments qui soutiennent un métabolisme sain – tels que les amidons résistants ou les plantes riches en polyphénols – InnerBuddies permet aux utilisateurs de prendre des décisions informées sur le plan microbien qui complètent leurs objectifs de santé et leurs stratégies de gestion du poids.
-
Santé de la peau
Les affections cutanées comme l'acné, l'eczéma et la rosacée sont de plus en plus liées aux déséquilibres intestinaux et à l'inflammation systémique. InnerBuddies analyse votre microbiome pour détecter des schémas qui peuvent contribuer à des réactions cutanées inflammatoires.
En soutenant l'intégrité de la barrière intestinale et en réduisant les microbes pro-inflammatoires, les recommandations d'InnerBuddies peuvent aider à améliorer la peau de l'intérieur vers l'extérieur — favorisant un teint plus clair et moins de poussées grâce à une prise de conscience de l'axe intestin-peau.
-
Nutrition personnalisée
Tous les aliments ne sont pas bénéfiques pour chaque intestin. InnerBuddies propose des insights nutritionnels personnalisés basés sur votre profil microbien unique — identifiant les aliments qui nourrissent les bonnes bactéries et signalant ceux qui pourraient provoquer une dysbiose.
Cette approche personnalisée aide les utilisateurs à dépasser les régimes alimentaires standard et à adopter des stratégies nutritionnelles favorables à la flore intestinale. Que vous optimisiez pour l'énergie, la digestion ou la longévité, InnerBuddies transforme vos données microbiotiques en plans de repas applicables.
Écoutez nos clients satisfaits !
-
"Je voudrais vous faire savoir à quel point je suis enthousiaste. Nous suivions le régime depuis environ deux mois (mon mari mangeait avec nous). Nous nous sentions mieux grâce à lui, mais nous n'avons vraiment réalisé à quel point que pendant les vacances de Noël, lorsque nous avons reçu un grand colis de Noël et que nous n'avons pas suivi le régime pendant un certain temps. Eh bien, cela nous a redonné de la motivation, car quelle différence au niveau des symptômes gastro-intestinaux mais aussi de l'énergie pour nous deux !"
- Manon, 29 ans -
-
"Super aide!!! J'étais déjà bien engagé, mais maintenant je sais exactement ce que je dois manger et boire ou non. Je lutte depuis si longtemps avec mon estomac et mes intestins, j'espère pouvoir m'en débarrasser maintenant."
- Petra, 68 ans -
-
"J'ai lu votre rapport complet et vos conseils. Merci beaucoup pour cela, c'est très instructif. Présenté de cette manière, je peux certainement avancer avec. Par conséquent, aucune nouvelle question pour l'instant. Je prendrai volontiers vos suggestions à cœur. Et bonne chance dans votre travail important."
- Dirk, 73 ans -